来源:强思咨询 时间:2018-6-27 15:07:11
2018年1月5日,国家食药监总局发布《关于上海市食品药品监督管理局开展医疗器械注册人制度试点工作的公告》。
2018年2月27日,上海市食药监局向上海远心医疗科技有限公司(以下简称“远心医疗”)的单道心电记录仪颁发医疗器械注册证,向上海微创电生理医疗科技股份有限公司颁发医疗器械生产许可证,该产品成为《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》颁布施行后获批上市的首个医疗器械产品,意味着上海去年推出的医疗器械注册人制度创新改革正式落地。
以往,我国医疗器械的注册与生产两大环节被“捆绑”在一起,必须由一个主体来完成注册与生产。这意味着,要么由医疗器械注册人自己设厂生产,要么由具备医疗器械注册证和生产许可证的企业来申请办理。这种“捆绑”模式影响了创新研发和持续提高产品质量的热情,也限制了创新要素合理配置,与国际通行规则和我国《医疗器械监督管理条例》的立法精神不符。
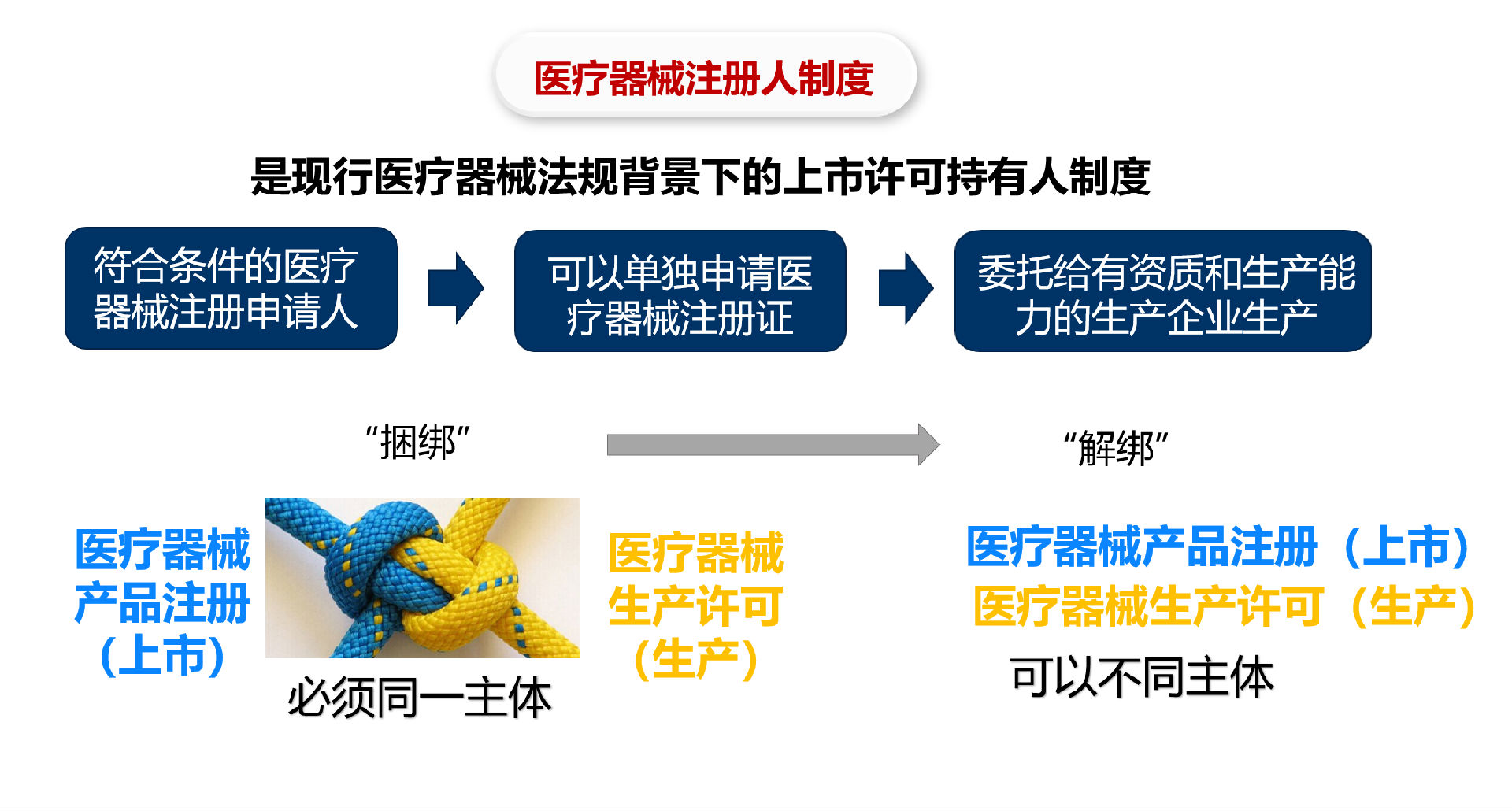

2018年5月4日,国务院发文《进一步深化中国(广东)自由贸易试验区改革开放方案》中提出允许自贸试验区内医疗器械注册申请人委托广东省医疗器械生产企业生产产品。《进一步深化中国(天津)自由贸易试验区改革开放方案》中提出允许自贸试验区内医疗器械注册申请人委托天津市医疗器械生产企业生产产品。截止目前已有包括上海自贸区在内3个试点区。这意味着众多在自贸区的医疗器械企业,尤其是研发创新型的企业将可以采取更快速、更简单、投资更小的方式来申请医疗器械产品注册证,而不是一定需要申请医疗器械生产许可证来自行生产。
2018年6月25日,司法部公布了新市场监管总局报请国务院审议的《医疗器械监督管理条例修正案(草案送审稿)》,并公开征求意见。
此次修正案的最大亮点在于完善医疗器械上市许可持有人制度、优化审批及鼓励创新。《医疗器械监督管理条例》于2000年首次发布,经历了2014年的大改(持有人制度的雏形出现)、2017年的小改(大型设备配置证制度)及2018年的突破性修改(持有人制度落地)。此次修改主要包括四个方面:进一步完善医疗器械上市许可持有人制度、改革临床试验管理制度、优化审批程序、完善上市后监管要求,我们认为其最大亮点是围绕2017年国务院鼓励药械创新的意见,落实医疗器械上市许可持有人制度及优化审批程序,有望成为鼓励器械创新的标志性政策。
从流程上看,司法部公示草案送审稿之后,即报送国务院,通过国务院常务会议审议即可生效执行(这与药品管理法修正案需要经过两会审议不同)。政策推进速度快于预期,我们预计《医疗器械监督管理条例修正案》最快可在年内生效。