医疗器械产品注册
问题一:什么是医疗器械?
答案一:医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。例如:监护仪、内窥镜、隐形眼镜、义齿、医用外科口罩、避孕套等等。
其目的是疾病的诊断、预防、监护、治疗或者缓解;损伤的诊断、监护、治疗、缓解或者功能补偿;生理结构或者生理过程的检验、替代、调节或者支持;生命的支持或者维持;妊娠控制;通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
具体产品是不是医疗器械,可结合医疗器械的定义和《医疗器械目录》进行初步的界定。
问题二:什么是医疗器械产品注册?
答案二:医疗器械产品注册是国家食品药品监督管理总局针对医疗器械产品上市前所指定的行政审批方式,要求所有的二类和三类医疗器械产品在上市前必须要先进行产品注册,注册完成后申请并获取了生产许可证之后方可上市。
问题三:医疗器械产品如何分类?
答案三:医疗器械分类的主要是依据国家药监总局于2015年颁布的《医疗器械分类规则》(第15号令)来进行分类。
医疗器械分为三大类,分别是一类、二类、三类;根据能量来源不同分为:无源医疗器械和有源医疗器械;根据灭菌与否分为:无菌器械和非无菌器械;根据接触皮肤的方式分为:植入性器械和非植入性器械。
医疗器械分类的几条特殊原则:
以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理;
可被人体吸收的医疗器械,按照第三类医疗器械管理;
对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理;
以无菌形式提供的医疗器械,其分类应不低于第二类。
通过牵拉、撑开、扭转、压握、弯曲等作用方式,主动施加持续作用力于人体、可动态调整肢体固定位置的矫形器械(不包括仅具有固定、支撑作用的医疗器械,也不包括配合外科手术中进行临时矫形的医疗器械或者外科手术后或其他治疗中进行四肢矫形的医疗器械),其分类应不低于第二类。
问题四:是不是所有的医疗器械产品都需要注册?
答案四:不是的。
一类医疗器械产品仅需进行产品备案和生产备案;
二类和三类医疗器械产品才需要产品注册和生产许可证。
问题五:怎么确认产品是否需要做临床试验?
答案五:医疗器械是否需要免临床,决定企业在进行产品注册时所需的时间和费用的长短和多少,对企业而言尤为重要。
医疗器械产品是否需要进行临床试验,主要是通过查询《免于临床试验的第二类医疗器械目录》和《免于临床试验的第三类医疗器械目录》,该目录目前已经分别在2014年、2016年和2017年分别发布了三批,详情可查寻国家食品药品监督管理局网站。
问题六:医疗器械产品注册需要什么材料?
答案六:医疗器械产品注册所需的材料主要是申请表、证明性材料(如营业执照)、安全有效基本要求清单、综述资料、研究资料、生产制造信息、临床评价资料、产品风险分析资料、产品技术要求、产品注册检验报告等十三项材料,详情请查看http://www.hubfda.gov.cn/wsbw/bszn/ylqx/ylqxzc/36042.htm
问题七:医疗器械产品注册需要多久?
答案七:医疗器械产品注册所需的过程和时间如下:
产品检测:40-80个工作日(结合实际情况预估)
注册申请:5个工作日(法定最长时限)
技术评审:60个工作日(法定最长时限)
体系考核:30个工作日;(法定最长时限)
行政审批:20个工作日(法定最长时限)
制证发证:10个工作日(法定最长时限)
以上时间(除产品检测外)是法规规定省药监的完成各项工作的最长时限,合计125个工作日,加上产品检测在165-205个工作日左右。
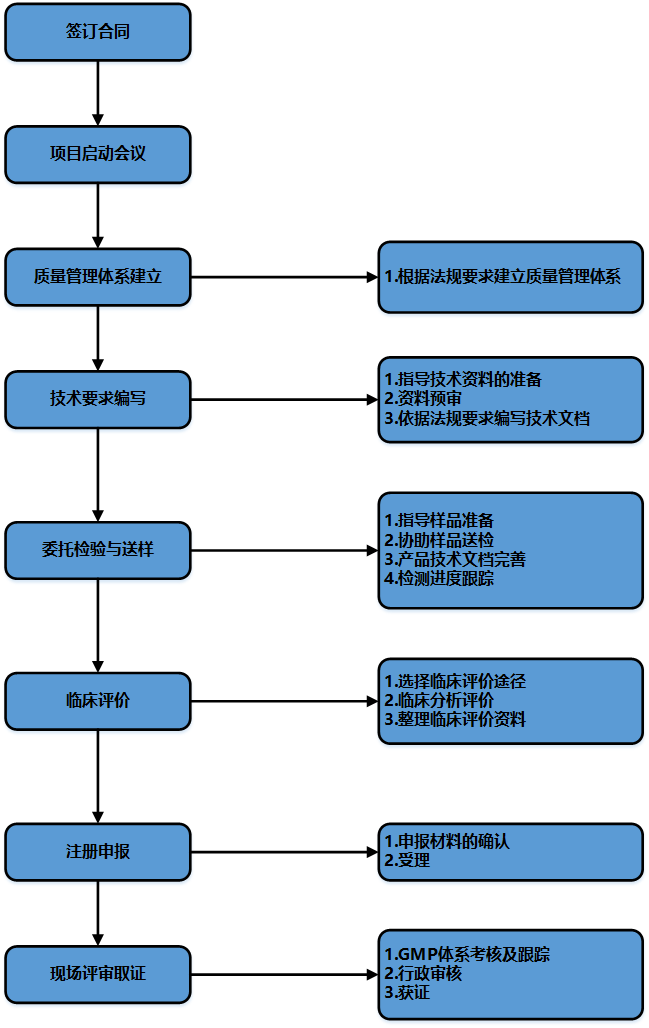
【服务流程】