来源:强思咨询 时间:2018-7-17 14:32:44
强思咨询7月17日讯,日前,国家药品监督管理局向社会公众通告了8家医疗器械企业的飞行检查情况,为了让广大的医疗器械企业深入了解飞行检查的重点,更好贯彻和落实《医疗器械生产质量管理规范》(下称规范)及其相关附录的要求,我司在此特别对其进行数据分析。
目前国家药品监督管理总局通报的8家企业的基本情况如下:
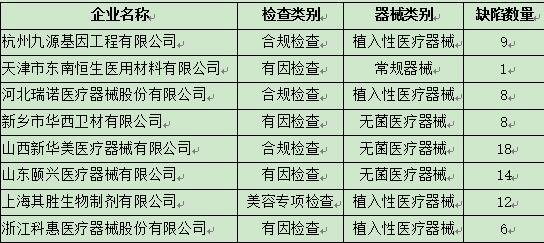
从列表中,我们可以看出,本次飞行检查的重点依旧是:植入性医疗器械和无菌医疗器械。
通过本公司对本次飞行检通报的详细信息进行分析得知,本次飞检得出的主要缺陷除了第一章总则,其它项目基本全部涉及。其详细情况如下:
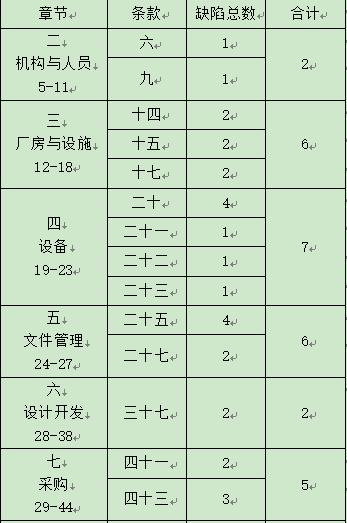
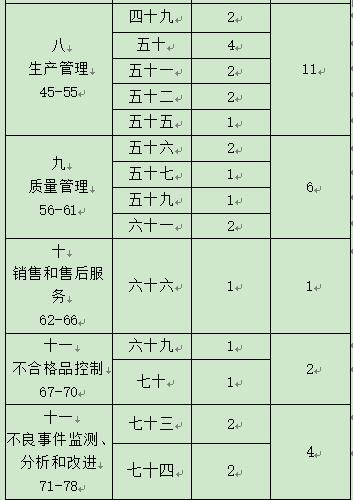
从统计表中我们可以看出,“厂房与设施”、“设备”、“文件管理”、“采购”“生产管理”、“质量管理”这6个章节分别都涉及5个或者以上的管理缺陷,其中“不良事件监测、分析和改进”也涉及4个管理缺陷。
针对本次飞行检查的问题,各大医疗器械企业需要详细解读,举一反三,检查确认企业自己本身是否也存在类似的问题并进行分析改进,进一步为社会公众提供优质可靠的产品,为企业本身降低风险。
强思咨询专业提供医疗器械认证咨询服务和ISO标准认证咨询服务。公司提供的主要咨询服务包括:医疗器械产品注册、医疗器械GMP、医疗器械经营许可证、医疗器械CE认证、FDA注册和列名、ISO 13485体系认证、9001质量体系认证、22000食品安全认证、14001环境体系认证、18001职业健康认证等ISO体系认证。了解更多相关信息,请登录强思咨询官网:www.whqszx.com,或者拨打电话:027-59250256。